结构化学基础壹
约定:本文用加粗标记定义或概念,实验名称由斜体标注。本文中所有图片均为网图,侵删。
1. 经典核原子模型
1.1 电子的发现
如图,在一个两端各嵌有一个金属电极的玻璃管中施加几千伏特的高压,并将管中气体抽成真空。可以看到荧光屏上出现了一条笔直的荧光带。
给管中是假一个磁场(用磁铁吸引),可以观察到阴极射线发生了弯曲。该电子流具有负电荷。
利用该装置还能测出电子的电荷 $e$ 与其质量 $m$ 之比值,称作荷质比。
1.1.1 测定电子的速度
若电子的电荷为 $e$ 、速度为 $v$ ,电场强度为 $E$ ,磁场强度为 $H$ ,如果电子所受的磁力和电力相等,则有:
\[H·e·v=E·e\]即:
\[H·v=E \iff v=\frac{E}{H}\]这样就能算得电子的速度。
1.1.2 测定电子的电荷
$1909$ 年字母哥 $Millikan$ 设计的油滴实验可以巧妙地测出电子的电荷。在电场中喷入微小的油滴,并同入 X 光使空气电离,这样小油滴就能在电场力和重力之间平衡。所受电场力和电荷 $e$ 有关,而重力有和 $m$ 有关。 $m$ 是已知的量,若每个油滴只带有一个电荷,那么最小的电荷量 $e$ 就能求出。最终实验得到 $e=1.6 \times 10^{-19} C$ ,电子质量 $m_e = 9.11 \times 10^{-31} kg$ 。
1.2 原子模型的发展史
1.2.1 早期的模型
- $1897$ 年前后, $J.J. Thomson$ 通过实验提出了葡萄干布丁模型。
- $1911$ 年,英国物理学家 $Rutherford$ 通过 $\alpha$ 粒子散射实验,否定了汤姆森的模型,建立了核原子模型。
在该实验中,大部分粒子通过了金箔,并没有改变运动方向,少部分粒子发生偏转,更少部分被反弹或原路返回。该实验能够得出以下结论:
- 原子核内部很空旷,中间的有一个原子核且带正电。
- 整个原子的全部质量几乎都集中在这个原子核上。
- 带负电的电子高速在核外绕核转动。
估算金箔原子核的大小:$\frac{1}{2}mv^2=K\frac{Z_1eZ_2e}{r_0}$ ,其中左边为假定粒子的动能,右边为该粒子最靠近原子时转化成的库伦排斥势能。 $Z$ 分别表示两者的核电荷数( $2$ 与 $79$ ), $r_0$ 表示该最近的距离。
1.2.2 普朗克量子论
1.2.2.1 黑体辐射实验
绝对黑体是指能全部吸收辐射电磁波的物体(看上去就是完全黑色的,理想化模型),在受热时能发出连续波长的电磁辐射。下图为黑体在不同温度下,电磁辐射波长与强度的关系图像。
由图,虚线表示经典力学中,随着波长减小,辐射强度应该无限增大。然而在实验观测中,当波长进入了紫外区,出现了经典力学无法解释的现象。这就是紫外灾难。
$1900$ 年,普朗克第一次提出量子的概念。他认为,能量是不连续的,最小的能量单位称作量子。具体来说,一个量子的能量与其电磁波的频率成正比:
\[E=hv\]其中, $h \approx 6.62607015 \times 10^{-34} J·s$ 称作普朗克常数,$v$ 为电磁波的频率。
例题:电磁辐射波长为 $122mm$ 的光子能量为多少?
1.2.2.2 光电效应
爱因斯坦使用普朗克量子论解释了该实验,认为光由光子组成,它的能量也是不连续的。用公式来表示,就是:
\[hv=E=W+E_k\]其中,$hv=E$ 即为光子碰撞到电子上,让电子吸收的能量。 $W$ 为电子克服原子对它的束缚进而逃逸的最小能量, $E_k$ 就是剩下的能量,全部转换为动能,用于电子获取速度。
由此可见,只有当 $E>W$ 时,提供的能量大于所需的最小能量,才能触发光电效应。而 $E$ 只和光子频率 $v$ 有关。这就必须使用量子的角度解释。
波长、波速与频率之间的关系:$\lambda = \frac{V}{v}$ ,即 $波长 = \frac{波速}{频率}$ 。当我们在研究标准的光的时候,可以将光速 $c$ 带入波速 $V$ 。
1.2.3 波尔 $Bohr$ 理论
要点:电子在轨道上,而轨道具有一定的能量。
1.2.3.1 $Balmer$ 经验公式
氢原子光谱上各个光的波长可由以下经验公式得出。其中 $n$ 为大于等于 $3$ 的正整数,通过变换 $n$ 的数值,可以得到多个 $\lambda$ ,这些波长都为氢原子所具有。
\[\lambda = \frac{3646.00 \times n^2}{n^2-4}\]进而可以计算波数:
\[\overline{v} = \frac{1}{\lambda}\]1.2.3.2 原子的轨道能量
\[E=-\frac{13.6 Z^2}{n^2}eV\]其中, $Z$ 为核电荷数, $n$ 表示原子的第几层轨道。
当 $Z=1, n=1$ 时,氢原子 $K$ 层的半径为 $53pm$ ,称作波尔半径。
离原子核越近,能量越低,越稳定。电子层(又称能层),从里到尾分别是 $K$,$L$,$M$,$N$ 。
1.3 微观粒子的波粒二象性
波粒二象性,指微粒既具有波动性又具有微粒性。并且这样的微观粒子不可能同时准确测定位置和动量,即测不准性或不确定性。
- 光的波性:干涉、衍射现象;
- 光的粒性:发射、吸收、光电效应。
1.3.1 爱因斯坦质能方程
当我们认为光子是粒子时,就可以认为它具有的能量为 $E=mc^2$ 。
然而,光又是波。故 $E=hv=mc^2$ 。
求得动量: $P=mc=\frac{hv}{c}=\frac{h}{\lambda}$ 。
电子的波长也就可以求得: $\lambda=\frac{h}{mV}=\frac{h}{P}$ 。
在等式 $hv=mc^2$ 中,我们可以看到,波动性和微粒性间搭建了一个桥梁。
1.3.2海森堡不确定原理
\[\Delta x \Delta P \geq \frac{h}{4\pi} \iff \Delta x \geq \frac{h}{4\pi m \Delta v} \iff \Delta x \Delta v \geq \frac{h}{4\pi m}\]在宏观世界中,$m$ 很大,所以 $\Delta x \Delta v$ 的误差很小。但在微观世界中,$m$ 很小,所以 $\Delta x \Delta v$ 的误差就难以预测了。
2. 薛定谔方程(简化版)
笔者只也只会介绍薛定谔方程中的几个参数,用以解释现代原子轨道理论。
2.1 前置技能
2.1.1 概率密度与电子云
在上一节的“海森堡不确定原理”中,我们已经知道了在微观世界中,粒子是难以预测的,所以之前波尔所提出的电子在轨道上运动,就显得有些问题了。电子的运动是不确定的、无法预测的,它不一定就在某个轨道上乖乖运动。那么,科学家们又该如何进一步研究呢?
实际上,我们并非非得要算出电子的运动轨迹。我们只要统计电子在各个位置的分布,就能大概了解电子的运动情况。
在一个空间中,我们定义概率密度 $\rho=\frac{P(概率)}{V(该处的体积)}$ 。
随后,我们将这个概率密度形象地表示在一个三维空间中,便得到了电子云(概率密度分布图)。
再将空间出现概率 $P=90 \%$ 的空间圈出来,就得到了电子云轮廓图。一个轮廓图对应一个原子轨道,一个原子当然有多个轨道。
2.1.2 波函数
$\psi$ 即为电子波函数,而 $\psi^2$ 就可代表电子在空间某点出现的概率密度。
2.1.3 径向分布图像
对于某个轨道,$\psi^2$(某点的概率密度,纵轴)和与原子核中心的距离的关系图像,可由下图表示:
该图的物理意义是,单位厚度球壳内电子的分布概率。
2.2 方程的参数
2.2.1 主量子数 $n$
表示轨道离原子核的远近(决定了电子能级)。
可以取任意正整数,表示是第几层的轨道。
2.2.2 角量子数 $l$
决定了电子的轨道形状。
取值范围:$0, 1, 2, 3, 4, …, (n-1)$ 。
分别对应:$s, p, d, f, g, …$ (例如对于第 $n=2$ 层,可能为 $s$ 或 $p$ 轨道)。
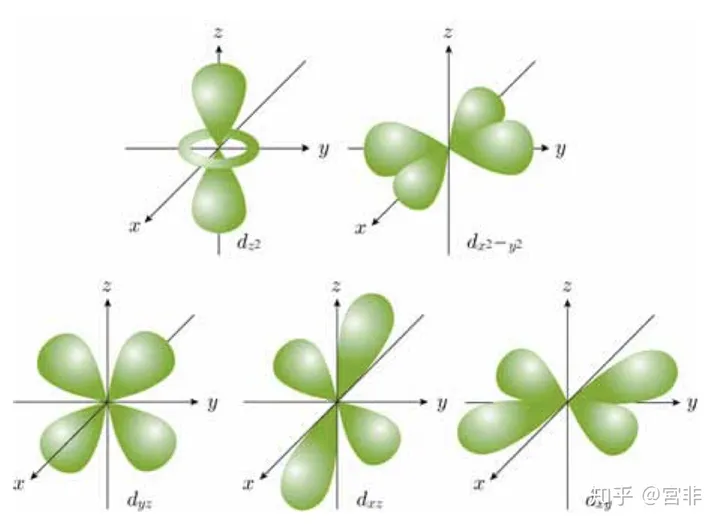
不同的轨道有不同的形状。 $s$ 轨道为球形,$p$ 轨道为哑铃形,$d$ 轨道为花瓣形,等等。具体的形状图见下一小节。
2.2.3 磁量子数 $m$
决定了轨道的方向。
取值范围:$0, \pm 1, \pm 2, …, \pm m$ 。
注意:同一个 $n$ ,同时存在着不同的 $l$ 形轨道,而即便对于同一个 $l$ 形轨道,也同时存在着多个形状相同但方向不同的、也就是磁量子数 $m$ 不同的轨道。具体见下图。
2.2.2.1 $s$ 轨道的形状(只有一个)
2.2.2.2 $p$ 轨道的形状(共三个)
2.2.2.3 $d$ 轨道的形状(共五个)
例题:$n=4, l=2, m=0$ 的轨道名称是什么?
2.2.4 自旋量子数 $m_s$
决定了这个电子在某个轨道上的“自转”方向。
取值只有两个:$+\frac{1}{2}, \ -\frac{1}{2}$ 。分别表示正着转和反着转。
2.3 泡利不相容原理
不存在 $4$ 个量子数完全相同的电子。我们可以认为, $\psi$ 函数就是用来针对各个电子的。
2.4 小补充
2.4.1 能级的排布
每个轨道的能量由 $n$ 和 $l$ 确定。一般地, $n$ 越小, $l$ 越小,能量 $E$ 越小。
有时候,两个轨道的远近一样( $n$ 一样),但能量不同(由 $l$ 不同引起),这就叫做能级分裂。
有时候,离核近的轨道反而能量更高,这就叫做能级交错,主要是因为受到了其他电子的排斥而能量增大。
如何准确地对各个能级进行排序呢?请见下节。
2.4.2 徐光宪近似规律
可以用来比较各个轨道能量的大小。
- 对于原子而言:$(n+0.7l)$ 越大,能级越大。
- 对于粒子而言:$(n+0.4l)$ 越大,能级越大。
2.4.3 能级的计算&屏蔽效应
- 对于单电子原子能级,有 $E=-\frac{13.6}{n^2}eV$ 。
- 对于多电子原子能级,有 $E=-\frac{Z^{*2}}{n^2}eV=-\frac{(Z-\sigma)^2}{n^2}eV$ 。
其中, $Z$ 为核电荷数, $\sigma$ 为屏蔽常数。
为什么多电子原子能级要有减去 $\sigma$ 这样的操作呢?这就是由于屏蔽效应,内层电子会对外层电子产生排斥,相当于将原子核的引力削弱了一部分。
我们可以使用斯雷特规则来计算屏蔽常数 $\sigma$ 。
2.4.4 能级分裂的原因——钻穿效应
3 能级排布
3.1 能级排布规律图
由种种实验事实,人们总结出了一张图表,能帮助我们快速对能级进行排序。
由上图,我们可以看到,各个轨道的能量:$1s<2s<2p<3s<3p<4s<3d<4p<5s$ ,等等。
3.2 电子排布式
我们将电子依次填入能量低到能量高的轨道。其中,每个 $s$ 轨道最多放 $2$ 个,每个 $p$ 轨道最多放 $6$ 个,每个 $d$ 轨道最多放 $10$ 个,每个 $f$ 轨道最多放 $14$ 个,等等。
接着,我们把放了多少个电子写到轨道的右上角。最后,我们还要将所有轨道按顺序排列。
以 $Na$ 为例: $1s^2 2s^2 2p^6 3s^1$ 。
而 $K$ 可以简写:$[Ar]4s^1$ 。
但 $19$ 种元素原子的外层电子分布有例外。其中主要为 $_{29}Cu:\ [Ar]3d^{10}4s^1$ 。
3.3 洪特规则
- 尽可能成单电子排列且自旋方向相同。
- 简并轨道、全空、半满或全满比较稳定。